Ultimo aggiornamento 11 Giugno 2020
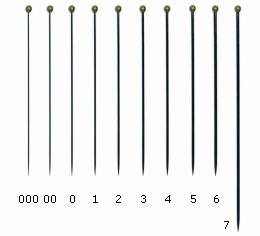
Una buona preparazione degli esemplari facilita lo studio e l’identificazione degli stessi. Si consiglia pertanto di evitare raccolte di esemplari incollati in posizione di morte (appallottolati), o immersi in troppa colla, così come è bene evitare di spillare gli esemplari con spilli troppo grossi, che potrebbero nascondere o distruggere alcuni caratteri. Comunque, se siete abituati a spillare gli esemplari, si dovrebbero utilizzare gli spilli entomologici di misura standard #00 o #0, inserendoli in un’area centro-laterale del torace, come si fa con gli imenotteri e i coleotteri. Oppure, si possono utilizzare i microspilli, conosciuti anche come ‘minuten pins’, che hanno un diametro di 0.10mm, 0.15mm, 0.20mm e 0.25mm.
|
No.
|
length
mm |
Ø
mm |
|
000
|
38
|
0.25
|
|
00
|
38
|
0.30
|
|
0
|
38
|
0.35
|
|
1
|
38
|
0.40
|
|
2
|
38
|
0.45
|
|
3
|
38
|
0.50
|
|
4
|
38
|
0.55
|
|
5
|
38
|
0.60
|
|
6
|
38
|
0.65
|
|
7
|
52
|
0.70
|

In alternativa, si possono usare i cartellini entomologici tradizionali, fatti di cartoncino Bristol di alta qualità, con i bordi leggermente arrotondati.
Noi preferiamo i cartellini trasparenti in acetato, che facilitano l’esame dei caratteri diagnostici presenti nella faccia ventrale dell’esemplare.
Se, pertanto, si useranno i cartellini entomologici, indipendentemente dal fatto che siano bianchi o trasparenti, suggeriamo di adottare poche misure standard soltanto, come ad es. 15x6mm e 20x8mm, che si adattano alle taglie medie dei Crisidi e garantiscono una notevole omogeneità alla collezione.
Preparazione degli esemplari
I Crisidi vanno maneggiati con pinzette a presa morbida, evitando di prenderli per le articolazioni o per le zampe o per le antenne; il torace fortemente chitinico è una buona zona di presa. Un pennellino morbido è invece utile per distendere zampe e antenne.
Vi sono delle differenze sostanziali fra la preparazione di esemplari freschi e morbidi e quella di esemplari secchi e rigidi. Nel secondo caso è necessario ammorbidire gli esemplari prima di poterli preparare.
Preparazione di esemplari freschi
Quando gli esemplari sono morbidi, come quelli appena catturati, è possibile montarli direttamente sul cartellino entomologico, utilizzando il pennellino per allargare le zampe, le ali e le antenne. Se non si ha il tempo per preparare subito gli esemplari appena raccolti, allora è possibile conservarli in una provetta contenente un batuffolo di cotone imbevuto di poche gocce di etere acetico (che impedisce la formazione di muffe). Questo metodo consente di mantenere gli esemplari morbidi per mesi. Se si desidera conservarli morbidi per ancora più tempo, allora è possibile tenere le provette in freezer.
Preparazione di esemplari secchi
 Se gli esemplari sono secchi (disidratati) e li si vuole ripreparare, bisogna riumidificarli per qualche ora in un barattolo ermetico contenente cotone e acqua (camera umida), proprio come si fa per gli altri insetti.
Se gli esemplari sono secchi (disidratati) e li si vuole ripreparare, bisogna riumidificarli per qualche ora in un barattolo ermetico contenente cotone e acqua (camera umida), proprio come si fa per gli altri insetti.
Un metodo per riumidificare velocemente esemplari singoli consiste nell’usare una siringa per forzare l’ingresso di acqua nell’esemplare. Per prima cosa si rimuove l’ago, che non serve; poi si inserisce l’esemplare secco nella siringa e la si riempie parzialmente d’acqua. Poi si gira la siringa verso l’alto e si premere il pistone per eliminare l’aria; dopodiché, chiudendo il beccuccio con un pollice per fare il vuoto, si tira lentamente il pistone: in tal modo l’aria contenuta nell’esemplare viene estratta in modo forzato e sostituita da acqua, che umidificherà rapidamente l’esemplare, il quale potrà essere montato sul cartellino entomologico, se si è ammorbidito a sufficienza, oppure potrà essere preparato su un pannello di preparazione.
Estrazione e montaggio dei segmenti addominali interni
Dal momento che i genitali maschili hanno caratteri diagnostici, è utile estrarre i segmenti addominali interni contenuti nell’addome, ma questa è un’operazione che richiede un po’ di manualità e di esperienza. Si posiziona l’esemplare con la faccia ventrale verso l’alto, e si inserisce la punta di uno spillo fra sterniti e tergiti addominali, estraendo il pacchetto dei segmenti interni, che può essere posizionato su un cartellino entomologico. A quel punto, sotto il microscopio stereo, si può incollare il pacchetto al cartellino, aiutandosi con degli spilli per separare i singoli segmenti e la capsula genitale.
Il pannello di preparazione
 Quando è necessario preparare con particolare cura l’esemplare, o perché l’esemplare non è abbastanza morbido da poter essere montato direttamente sul cartellino, si ricorre ad un pannello di preparazione. Un buon materiale per queste finalità è il polistirene espanso in fogli per uso edilizio, noto come Styrofoam™, che consente di inserire ed estrarre gli spilli (misure 00, 0) con facilità e di tenerli bene in posizione fino ad essiccamento dell’esemplare.
Quando è necessario preparare con particolare cura l’esemplare, o perché l’esemplare non è abbastanza morbido da poter essere montato direttamente sul cartellino, si ricorre ad un pannello di preparazione. Un buon materiale per queste finalità è il polistirene espanso in fogli per uso edilizio, noto come Styrofoam™, che consente di inserire ed estrarre gli spilli (misure 00, 0) con facilità e di tenerli bene in posizione fino ad essiccamento dell’esemplare.
Con le pinzette si posiziona l’esemplare a pancia in giù e lo si blocca al piano tramite due o tre spilli che incrociano il torace. Con altri spilli si posizionano zampe, testa, antenne e ali per dare loro un assetto simmetrico. Zampe e ali non vanno posizionate troppo a ridosso del corpo, in modo da consentire l’esame successivo di alcuni caratteri diagnostici.
L’esemplare così preparato rimarrà sul pannello per alcuni giorni, in base all’umidità ambientale. Gli esemplari catturati da poco impiegheranno più tempo ad essiccarsi, per via dei tessuti molli interni.
Incollaggio sul cartellino entomologico
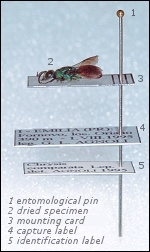 Una volta essiccatosi, l’esemplare può essere incollato su di un cartellino di misura adeguata e simile agli altri cartellini utilizzati per esemplari di stazza simile. Una piccola goccia di colla posta in corrispondenza del torace dell’esemplare è sufficiente ad incollarlo al cartellino, e a mantenerlo incollato. La colla deve essere facile da trovare/preparare e facile da rimuovere dall’esemplare tramite umidificazione, come una normale colla vinilica.
Una volta essiccatosi, l’esemplare può essere incollato su di un cartellino di misura adeguata e simile agli altri cartellini utilizzati per esemplari di stazza simile. Una piccola goccia di colla posta in corrispondenza del torace dell’esemplare è sufficiente ad incollarlo al cartellino, e a mantenerlo incollato. La colla deve essere facile da trovare/preparare e facile da rimuovere dall’esemplare tramite umidificazione, come una normale colla vinilica.
Etichettatura
L’esemplare così montato deve riportare il cartellino di cattura, con i seguenti dati:
- luogo di raccolta: Paese, Stato, Regione, Città, località, etc.;
- elemento geomorfologico, come lago, foresta, fiume, etc.;
- coordinate, se note;
- data di raccolta, usando una convenzione internazionale per la quale il mese è indicato in numeri romani, ad es. 12.XII.2000 (in cui XII = 12 = dicembre);
- nome del raccoglitore, ad es. “leg. C. Darwin” (in cui “leg.” deriva dal latino legit, che significa raccolse) o “C. Darwin coll.” (in cui “coll” è l’abbreviazione di “collected”, raccolse), a seconda che si usi una terminologia latina o inglese).
Si possono poi aggiungere eventuali note sintetiche sul ritrovamento, ad es. “su fiore di Daucus“, su un altro cartellino.
E’ bene evitare simbologie e numerazioni eccessivamente personali, dal momento che un giorno quegli esemplari potrebbero essere scambiati o donati ad un Museo e i cartellini troppo criptici potrebbero rappresentare un problema per chi dovrà interpretarli.
Ecco alcune delle abbreviazioni che è possibile trovare sulle etichette di identificazione e località:
| ABBREVIAZIONE | DAL LATINO | SIGNIFICATO |
|---|---|---|
| aff. | affinis | affine ma non identico a; esempio: Chrysis aff. ignita. |
| auct. | auctorum | degli Autori |
| ca. | circa | circa [riferito a date] |
| cf. | confer | confronta con; esempio: Chrysis cf. ignita. |
| et al. | et alii | e altri [Autori] |
| ibid. | ibidem | dal medesimo luogo |
| id. | idem | il medesimo |
| in coll. | in collectionem | in collezione [generalmente seguito da un nome di persona o da quello di un Museo] |
| indet. | indeterminans | indeterminato o non identificato |
| in litt. | in litteris | in corrispondenza, usato per dai non pubblicati |
| leg. | legit | raccolto [seguito o preceduto dal nome del raccoglitore] |
| loc. cit. | loco citato | nel luogo citato, nel passo citato o sopra riportato |
| n.b. | nota bene | nota bene |
| s.l. | sensu lato | in senso ampio |
| sp. | species | specie [singolare; il plurale è species, abbreviato in spp.] |
| sp. nov. | species nova | nuova specie [singolare; il plurale è species novae, abbreviato in spp. nov.] |
| ssp. | subspecies | sottospecie [singolare; il plurale è sottospecie, abbreviato in sspp.] |
| s. str. | sensu stricto | in senso stretto |
Altre abbreviazioni sono elencate qui.
Dichiarazione su copyright, autore e proprietà
Tutti i contenuti di questa pagina sono copyright ©️ Chrysis.net se non diversamente specificato - si prega di consultare i singoli casi per dettagli sulla paternità e sul copyright. Gli esemplari nelle foto provengono dalle collezioni personali degli autori o di altri collaboratori e dalle collezioni di vari musei. Salvo diversamente specificato, l'intero contenuto di questo sito Web è a scopo personale, non commerciale, scientifico ed educativo con giusto accredito alla pagina da cui è stato derivato, e conformemente ai Termini e condizioni di Chrysis.net.
Per citazioni
Agnoli G.L. & Rosa P. (2025) Preparazione dei Chrysididae, in: Chrysis.net website. Interim version 02 July 2025, URL: https://www.chrysis.net/it/chrysididae/preparazione-dei-chrysididae/.




